by 樋上照男 信州大学理学部化学科
- はじめに
今回紹介する光電池,光電気化学蓄電池(Photoelectrochemical Condenser,PEC)は,フラーレン(C60)の光化学反応に基づいて提案された光電池で,フラーレンに太陽光(波長範囲が400 ~ 700 nmのいわゆる可視光)を照射するときに生成し,還元剤として機能するフラーレンのモノアニオンラジカル(C60– • )と適当な酸化剤,例えば,酸素(O2)との酸化還元反応によって構成される電池である。
PECの特徴は,
1) 太陽光を利用する電池であること
2) 蓄電池としての性質をもつこと
である。1)の特徴は,上に述べたように,太陽光照射によってフラーレンからそのモノアニオンラジカルが生成する事実に由来し,2)の特徴は,このモノアニオンラジカルが酸素等の酸化剤と接触しなければ,安定にかつ長時間保存できることに依る。簡単に言うと,PECは,太陽の光エネルギーをフラーレンのモノアニオンラジカルという物質に変換し,必要に応じて,これを酸素等の酸化剤と接触させて電気を取り出すことができる電池である。
従来の太陽電池は太陽の光が当たっている昼間しか発電できず,余分の電気は畜電器に蓄電する必要がある。しかし,PECではこの必要がなく,太陽の光エネルギーをフラーレンのモノアニオンラジカルという物質として蓄え,これを用いて,直接,電気として取り出すことができる。すなわち,PECは太陽の光が当たっている昼間はもとより夜間でも電気を取り出することができる新しいタイプの光電池である。
現在,実用化に向けての研究中であるため,PECの用途について明確なことを述べることはできないが,PECも従来のシリコンの太陽電池と同様な用途で利用できると考えられる。電池の活性物質としてフラーレンの大規模な生産が行われつつある現在,PECの民需用電池として利用することは容易に想像できる。さらに進んで,大規模な太陽電池としての利用も夢ではない。
以下に,PECの原理となったフラーレンの光化学反応についての実験結果と現在のPECの研究成果を述べる。 - 可視光照射によるフラーレンからフラーレンのモノアニオンラジカルの生成
フラーレン(C60)は,当時炭素系星 間物質の研究を行っていたハロルド・クロトーらにより1985年に発見された分子で,図1に示すように,炭素原子60個からつくられサッカーボールのよう に美しい形の分子である。このフラーレンを,テトラオクチルアンモニウム・テトラフェニルボレート(TOATPB,一種の塩で溶媒に溶けて陽イオンのテト ラオクチルアンモニウムイオンと陰イオンのテトラフェニルボレートイオンに解離する。)を含むニトロベンゼン(NB)溶液に酸素のない状態で溶解しこれに 可視光を照射すると,最初,紫色であった溶液の色が褐色に変化した。(図2)可視・近赤外吸収スペクトルの測定から,この溶液の色の変化は,光照射下にお いて励起されたフラーレンがテトラフェニルボレートから電子を1つ奪い,フラーレンのモノアニオンラジカル(C60– • )に光還元された結果であることが確かめられた。生成したモノアニオンラジカルは酸素のない状態では非常に安定であったが,溶液に酸素を吹き込むや否や溶 液の色が元の紫色に戻り,モノアニオンラジカルが元のフラーレンに戻ったことが分かった。その後の研究から,全てのモノラジカルアニオンがフラーレンに戻 るわけではないことや電子を奪われたテトフェニルボレートがビフェニルとジフェニュルボラン酸に分解することも確かめられた。 - 電池の構成
電池を構成するには,一般に,標準電位の異なった2つの酸化還元反応が必要である。フラーレンからフラーレンへのモノアニオンラジカルへの光還元反は,C60 + e– ⇄ C60– • (可視光の照射下において) (1) と表すことができる。ここで,e- は電子を示す。これを1つの酸化還元反応として,もう1つの酸化還元反応と対にすれば電池が構成できる。もう1つの酸化還元反応として多くの候補があるが,C60– • は,1つの余分の電子をもっているため,還元剤として働くと考えられることから,現在の私達の研究では,強い酸化剤として働く物質の過マンガン酸イオン(MnO4– )の酸化還元反応を用いている。過マンガン酸イオンの酸化還元反応は
MnO4– + 8H+ + 5e– ⇄ Mn2+ + 4H2O (2) である。式(1)と式(2)を考慮してe- を消去すると,
5C60– • + MnO4– + 8H+ ⇄ 5C60 + Mn2+ + 4H2O (3) となる。これは過マンガン酸イオンがフラーレンのモノアニオンラジカルを酸化する反応である。この反応は自発的に起きる。そのため,これら2つの酸 化還元反応を対にすれば電池を構成することができる。この起電力の大きさは式(2)の反応を別のものにすれば変えることが可能である。しかし,通常 2~3 Vが限界である。
- 実験用光電気化学蓄電池(PEC)
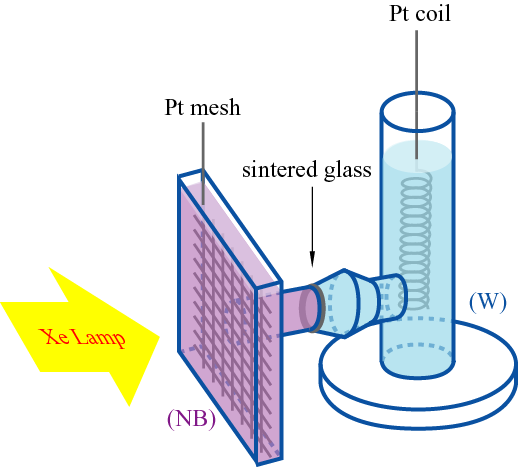
図3に実験用の光電気化学蓄電池(PEC)を示す。また,図4には実験中の写真を示す。PECを電池式で表せば,Pt (mesh)∣C60, TOATPB, (NB)∣MnO4–, 1 M硫酸 ∣Pt coil (4) となる。図3の左側の容器部分にフラーレンとテトラオクチルアンモニウム・テトラフェニルボレートのニトロベンゼン溶液が,焼結ガラス (sintered glass)を介して右側の容器部分には過マンガン酸カリウムの硫酸水溶液が入る。左側が疑似太陽光(波長範囲は400~700 nm,150 W以下)で照射される部分である。できる限り広い電極面積を確保するために,電極として2×2 cmの白金のメッシュ電極(細かい網状の電極)を,一方,右側の電極には白金線のコイルを使用している。このような実験用のPECを用いて,起電力(電極 間の電圧)と電流を測定したところ,起電力としては約0.8 V,電流として約0.4 mAを得た。さらに,光照射後,光照射を止めた後も,同様の起電力と電流を得ることができた。このことからも,PECが光エネルギーをフラーレンのモノア ニオンラジカルとして保存する電池であることが確かめられる。この実験用PECを用いて,市販の電子メロディーを鳴らすことができた。しかし,より高い起 電力(電極間の電圧)や大きな電流を取り出すために工夫が必要である。前者に対しては
1)対となる酸化還元反応の種類の検討,
後者に対しては
2)広い面積をもつ電極の使用,
3)電池の内部抵抗を減らすための高電気電導性ゲル溶液の使用,
4)低抵抗の液絡(膜)の使用
などが考えられる。今後これらの工夫を行いより高性能のPECの開発に努める予定である。 - おわりに
グリーンイノベーションが大きく取り上げられる現代において,私達がエネルギーをどのように確保していくかは重要な課題である。その1つとして,太陽光の利用は必須であり,光から電気を取り出す装置である太陽電池が今後も盛んに利用されることは容易に想像できる。ここで私達が紹介した光電気化学蓄電池(Photoelectrochemical condenser,PEC)は従来の太陽電池とは異なった特徴,すなわち,光エネルギーを物質として保存し,必要に応じて電気を取り出せる,をもった新しいタイプの光電池である。従って,これを実用化することは十分に価値のあることであろう。今後,PECの性能に関する多くの問題を解決し,より高い性能のPECを開発していきたい。
 |
 |
 |
 |